Хроматография в современном биотехнологическом процессе занимает особое место. Более 50% материальных ресурсов расходуется на выделение целевого вещества, которое в большинстве случаев осуществляется хроматографическими методами. Поэтому оптимизация хроматографического процесса, увеличение его производительности – исключительно актуальная задача.
В 2005 году была запатентована новая технология хроматографического разделения – многоколоночная противоточная очистка в градиенте растворителя (MCSGP), которая позволила скачкообразно увеличить эффективность технологий очистки по сравнению с традиционной периодической жидкостной хроматографией. При использовании MCSGP две идентичные колонки работают в противоточном режиме с внутренней рециркуляцией побочных фракций, содержащих примеси. В результате наиболее сложные для очистки вещества – пептиды и моноклональные антитела, могут быть выделены в производственных масштабах со значительно более высоким выходом без ухудшения целевой чистоты. Процесс позволяет повысить производительность до 10 раз при снижении расхода растворителя на 80%.
За последние годы требования к активным фармацевтическим субстанциям сильно возросли: степень очистки целевого вещества во многих случаях должна составлять не менее 99,5%, а примеси с содержанием до 0,1% необходимо выделить и охарактеризовать. Для многокомпонентных и сложных смесей достижение необходимых показателей может стать чрезвычайно сложной задачей. В большинстве случаев очистка веществ осуществляется хроматографическими методами, поэтому усовершенствование хроматографического процесса остается актуальной задачей. Хроматографические методы MCSGP, N-Rich – принципиально новая революционная технология в области хроматографии.
Новая технология разработана в Швейцарской высшей технической школе Цюриха (ETH) в лаборатории профессора Morbidelli M., 10-12 лет назад появился первый прототип оборудования и за это время из лабораторной практики технология вышла в промышленность.
 В общем виде существующие в хроматографии и в очистке субстанций задачи можно условно разделить на три группы: выделение целевого вещества с помощью аффинного связывания, разделение бинарных смесей, либо извлечение интересующего соединения из многокомпонентных смесей.
В общем виде существующие в хроматографии и в очистке субстанций задачи можно условно разделить на три группы: выделение целевого вещества с помощью аффинного связывания, разделение бинарных смесей, либо извлечение интересующего соединения из многокомпонентных смесей.
Практическими примерами разделения двухкомпонентных смесей может служить разрешение оптических изомеров или разделение фруктозы и глюкозы, которые решаются либо традиционными периодическими, или batch-методами, либо непрерывным процессом в псевдодвижущемся слое (SMB -Simulated Moving Bed) [ссылка на SMB от Кнауер в этом же разделе препаративной хроматографии].
Наиболее сложная задача – выделение целевого компонента или примесей из многокомпонентной системы. Селективность хроматографической системы часто бывает недостаточной, в результате наблюдаются наплывающие на основной компонент пики как во фронтальной, так и в хвостовой зоне. Как следствие, перед исследователем стоит проблема выбора между чистотой целевого вещества и его выходом. Увеличивая окно пула продуктов и включая области перекрывающихся пиков, можно добиться достаточно высокого выхода, однако чистота при этом снижается. С другой стороны, чистота может быть улучшена, если взять очень узкое окно продукта, но это происходит за счет уменьшения выхода. Эта дилемма присуща любому препаративному разделению на одной колонке. Для улучшения выхода часто прибегают к повторному хроматографированию фронтальной и хвостовой фракций, что в одноколоночной batch-хроматографии приводит к значительному удорожанию продукта.
Компромисс между выходом и чистотой может быть достигнут путем использования непрерывных методов противоточной очистки, когда две (или более) идентичные колонки, соединенные через несколько переключающих клапанов, работают во взаимосвязанном режиме. Среди непрерывных методов многоколоночная противоточная хроматография в градиенте подвижной фазы (MCSGP – Multi column countercurrent Solvent Gradient Purification) особенно хорошо подходит для очистки сложных смесей, содержащих примеси, которые элюируются вместе с целевым продуктом. Большое преимущество MCSGP перед другими методами непрерывной очистки состоит в том, что в нем может использоваться градиентное элюирование, необходимое для очистки больших биомолекул.
По сравнению с классической одноколоночной хроматографией многоколоночная противоточная градиентная хроматография позволяет повысить производительность в 3-10 раз, снизить капитальные вложения до 30%, уменьшить операционные расходы до 50%. Снижение расходов связано в первую очередь с уменьшением требуемого для очистки объема элюента, поскольку во многих случаях суммарная стоимость ВЭЖХ-процесса в значительной степени зависит именно от стоимости растворителей.
Принцип многоколоночной противоточной хроматографии в градиенте подвижной фазы
Представим, что мы имеем многокомпонентную смесь, в которой два пика примесей расположены рядом с пиком целевого вещества Р: пик слабоудерживаемого компонента W (от слова weak) и пик активно удерживаемого компонента S (от слова strong). Из-за частичного перекрывания пиков слева и справа от целевого пика образуются смесевые зоны, которые в традиционной batch-хроматографии отбрасывают или направляют на повторную очистку. Обычно процесс рехроматографии повторяют однократно, дальнейшие циклы нецелесообразны из-за расхода растворителей.
Теперь рассмотрим, как работает многоколоночная хроматография. Загруженная в первую колонку смесь элюируется градиентом растворителей, при этом сначала вымываются и отбрасываются слабоудерживаемые примеси W . В это время вторая колонка проходит стадию уравновешивания. Как только из первой колонки начинает элюироваться смесевая зона W / P, клапаны меняют конфигурацию, и элюат поступает на повторную очистку во вторую колонку. Чистый продукт Р, выходящий из первой колонки собирается , в это же время в колонку 2 загружается новая порция исходной смеси для компенсации потери продукта, собираемого из колонки 1. Вторая смесевая зона P/S, выходящая из первой колонки после элюирования чистого продукта, направляется на повторную очистку во вторую колонку. На этом этапе вторая колонка оказывается полностью загруженной, и начинается использование градиента, тогда как первая колонка промывается для выделения сильноудерживаемых примесей S. Теперь колонки меняются местами, и процесс начинается снова. Следует отметить, что перед загрузкой на вторую колонку смесевые фракции необходимо разбавить компенсационным буфером для того, чтобы они могли адсорбироваться на неподвижной фазе.
Таким образом, выделение целевого компонента можно проводить в непрерывном режиме, включающем следующие стадии:
1 стадия
- Вымывание примесей
2 стадия
- Рециклизация первой смесевой зоны
3 стадия
- Элюирование продукта
- Заполнение второй колонки новой порцией смеси
4 стадия
- Рециклизация второй смесевой зоны
Все смесевые зоны возвращаются в систему для разделения и находятся в ней, пока не будет выделено практически все целевое вещество. Кроме того, непрерывный режим помогает сэкономить время, тем самым увеличивается производительность.
Процесс MCSGP применим практически для любых градиентных разделений соединений различной молекулярной массы и различного происхождения, включая синтетические пептиды и олигонуклеотиды, моноклональные антитела и модифицированные белки.
Очистка моноклональных антител
В последние годы на фармацевтическом рынке появились новые виды биофармацевтических препаратов: конъюгаты антитело-лекарственное средство (ADC), такие как адцертис (брентуксимаб ведотин) и кадсила (адо-трастузумаб эмтанзин), и биспецифические антитела (bsAbs), такие как ремоваб (катумаксомаб). Проводятся клинические исследования других препаратов этих классов, поскольку они имеют большой потенциал в различных терапевтических областях, включая онкологию и противовоспалительную терапию. Среди компаний, развивающих этот процесс такие известные фирмы как Roche, Chugai, Novartis, Sanofi, Merrimack, F-star, Micromet, Genmab и другие.
В зависимости от технологии, используемой для производства этих биопрепаратов, реакционные смеси могут включать ряд примесей. В случае ADC это могут быть продукты с нежелательным соотношением лекарственное средство-антитело (DAR), а в случае биспецифических антител – исходные моноклональные антитела (гомодимеры).
Рассмотрим задачу выделения биспецифического антитела АВ. Биспецифические антитела гетеродимерны по своей природе. Каждая молекула имеет две разные вариабельные области и способна связываться с двумя разными мишенями, обеспечивая новые способы воздействия на поверхности клеток-мишеней. В последние годы был получен широкий спектр bsAbs путем перестройки и рекомбинации существующих доменов антител. Но поскольку bsAb обычно продуцируются совместной экспрессией двух различных тяжелых и/или легких цепей, невозможно избежать некоторого неправильного спаривания цепей. Обычно содержание и выход bsAb не превышает 36%.
Сложность хроматографической очистки AB заключается в том, что изоформы AA и BB элюируются близко к целевому пику, что приводит к их перекрыванию. Поэтому при периодической хроматографии только небольшая фракция продукта может быть выделена с требуемой чистотой 98%.
Используя метод MCSGP на препаративной катионообменной смоле и автоматизированную систему Contichrom биспецифическое иммуноглобулиновое антитело было выделено с выходом 87% и чистотой 98%. При периодической хроматографии в режиме линейного градиента полученный выход составил лишь 37%.
Очистка пегилированных белков
Один из путей повышения эффективности лекарственных препаратов белковой структуры – химическая модификация молекулы путем ковалентного присоединения фрагментов полиэтиленгликоля (ПЭГ). Пегилирование позволяет увеличить молекулярную массу лекарства и тем самым замедлить его выведение через почки, затруднить подход антител и протеолитических ферментов, а также оптимизировать биораспределение и улучшить растворимость. ПЭГ в качестве модификатора веществ пептидной структуры привлек внимание исследователей еще в начале 1970-х годов, а сегодня он одобрен Управлением по контролю за продуктами и лекарственными препаратами США (FDA) в качестве субстанции, разрешенной к использованию в медицине, продуктах питания и косметологии.
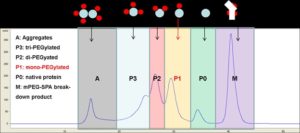 Выделение пегилированного белка с желаемой степенью полимеризации ПЭГ-фрагмента, например, монопегилированного продукта, представляет собой сложную задачу, поскольку в процессе синтеза образуется целый ряд химически близких веществ.
Выделение пегилированного белка с желаемой степенью полимеризации ПЭГ-фрагмента, например, монопегилированного продукта, представляет собой сложную задачу, поскольку в процессе синтеза образуется целый ряд химически близких веществ.
На рисунке представлена хроматограмма разделения на анионообменной смоле, полученная после пегилирования a-лактальбумина, где целевой монопегилированный белок обозначен буквой Р1. Традиционная одноколоночная хроматография позволила получить продукт с чистотой 93% и выходом 56%. Переход к MCSGP процессу увеличил выход и степень очистки, а также уменьшил расход элюента на 50%, что привело к повышению производительности процесса в 5 раз.
Технология выделения примесей N–Rich
Другая область применения многоколоночной противоточной градиентной хроматографии – выделение примесей. Задача выделения примесей чрезвычайно важна, поскольку в соответствии с требованиями нормативных документов, таких как ICH Q6A и Q6B, каждая примесь в активной фармацевтической субстанции должна быть выделена и охарактеризована. N-Rich решает проблему выделения, сочетая возможности препаративной хроматографии и преимущества непрерывного процесса.
 Процесс N-Rich включает три основные стадии. Первая стадия заключается в накопление целевой примеси P. Процесс начинается с загрузки части исходного материала в первую колонку и элюирования с линейным градиентом. Фракции, которые содержат целевое вещество, включая смесевые фракции, загружаются во вторую колонку, остальные фракции отбрасываются. Во вторую колонку дополнительно наносится исходная смесь. Процесс повторяется многократно, при этом происходит обогащение целевого соединения как по абсолютному значению, так и относительно соседних примесей W и S.
Процесс N-Rich включает три основные стадии. Первая стадия заключается в накопление целевой примеси P. Процесс начинается с загрузки части исходного материала в первую колонку и элюирования с линейным градиентом. Фракции, которые содержат целевое вещество, включая смесевые фракции, загружаются во вторую колонку, остальные фракции отбрасываются. Во вторую колонку дополнительно наносится исходная смесь. Процесс повторяется многократно, при этом происходит обогащение целевого соединения как по абсолютному значению, так и относительно соседних примесей W и S.
На второй стадии происходит очистка целевой примеси Р от мешающих соединений. Это достигается циклическим процессом, аналогичным первому этапу. Разница в том, что боковые смесевые фракции теперь отбрасываются, а новый исходный материал больше не добавляется.
На третьей фазе обогащенная целевая примесь элюируется в пологом градиенте, и соединение собирается с помощью тонкого фракционирования.
Примером применения метода N-Rich может служить идентификация примесей после твердофазного синтеза фибринопептида A – 16-аминокислотного пептида, участвующего в событиях коагуляции. Поскольку пептид относительно короткий, его синтез достаточно эффективен, однако, проведение 16 реакций образования пептидной связи и такого же количества реакций снятия защиты сопряжено с образованием ряда побочных продуктов, которые лишь незначительно отличаются от целевого вещества, например, отсутствием одной промежуточной аминокислоты. В то же время идентификация этих примесей важна как с точки зрения оптимизации процесса, так и в точки зрения токсикологической оценки необходимости их полного удаления.
После восьми циклов обогащения по технологии N-Rich концентрация примесей была достаточно высокой. Затем последовал однократный цикл выделения и, наконец, элюирование в пологом градиенте. В результате концентрация целевых примесей увеличилась более чем в десять раз, а концентрация по отношению к фибринопептиду А – более чем в 600 раз. Это сделало возможным выделить и охарактеризовать примесь, исходной содержание которой составляло менее 1,2%. Чистота примесей при этом оказывается на уровне 80%, что достаточно, например, для масс-спектрометрического определения состава.
Технологию N-Rich можно применять в протеомике или метаболомике для выделения микрокомпонента из биологической жидкости или природного экстракта. Процесс позволяет автоматически селективно сконцентрировать (1000x) целевые фракции. Обогащенные фракции могут быть проанализированы масс-спектрометрическими методами либо напрямую (сверху – вниз), либо после гидролиза (снизу – вверх).
Технология CaptureSMB для очистки моноклональных антител
Число лекарственных препаратов на основе моноклональных антител с каждым годом растет, и сегодня эти препараты входят в первую десятку по объему продаж. Поэтому оптимизация каждой стадии и технологической платформы в целом является актуальной задачей и на это направлены усилия целого ряда компаний. Для выделения моноклональных антител и химерных белков Fc часто используют аффинную хроматографию на сорбенте с иммобилизованным протеином А клеточных супернатантов. Несмотря на высокую стоимость такой смолы, ни одна из альтернатернативных технологий не способна сравниться с ней по своим характеристикам: динамической емкости, отделению белков-хозяев, устойчивости при регенерации в щелочи и т.д.
Затраты на этой стадии определяются стоимостью аффинного сорбента, поэтому снижение расхода сорбента исключительно актуально. Этого можно достичь, используя технологию CaptureSMB®, разработанную компанией Chromacon.
При периодической хроматографии колонка не может быть полностью загружена из-за проскока продукта, что приводит к использованию только 50-60% сорбента. Технология непрерывной хроматографии CaptureSMB, основанная на использовании двух идентичных колонок, позволяет выполнять очистку в два раза быстрее и экономить до 60% дорогостоящей смолы. В таком режиме первая колонка полностью насыщается, а проскок загружается во вторую колонку, после чего роли колонок меняются и процесс начинается с начала. Таким образом, эффективно используется весь аффинный сорбент, а выход продукта становится близок к количественному .
Оборудование для непрерывной хроматографии
Реализация методов многоколоночной непрерывной хроматографии MCSGP и N-Rich возможна как в лабораторных, так и в промышленных масштабах. Лабораторное оборудование выпускает швейцарская компания ChromaCon, промышленное – фирма LEWA. С 2019 года обе компании входят в корпорацию YMC.
Лабораторная система для непрерывной хроматографии Contichrom, которую производит ChromaCon, универсальна и позволяет разрабатывать процессы очистки во всех известных режимах жидкостной хроматографии (традиционный batch-процесс, SMB и многоколоночный градиентный режим) с помощью всего одного прибора и простого устройства для управления процессом.
Для этого необходимо разработать традиционный метод с оптимальными характеристиками для выделения целевого пика и фракционировать полученную хроматограмму для определения зоны, содержащей целевой и смесевые пики. Выделение выявленных зон делается на компьютере с помощью мышки, а программное обеспечение позволяет организовать весь дальнейший процесс.
Экономическая целесообразность применения MCSGP
Проведенное моделирование процессов получения и очистки 10 кг в год среднего модельного терапевтического пептида с использованием традиционной batch-хроматографии и многоколоночной непрерывной очистки MCSGP показало, что ежегодные затраты на очистку терапевтического пептида колеблются от 760 000 до 520 000 долларов США в случае одноколоночной периодической хроматографии, и составляют всего 208 000 долларов США при использовании MCSGP, что дает экономию средств не менее 40%. При этом основные затраты в первом случае приходятся на растворители и обеспечение контроля качества, а во втором – на капитальные расходы. Срок окупаемости при переходе на MCSGP-технологию оцениваются авторами от 6 до 19 месяцев.
***
В 2011 году в программном докладе AAPS 2011 директор Центра исследований и оценки лекарственных средств при FDA Джанет Вудкок (Janett Woodcock) заявила, что в ближайшие 25 лет фармацевтическая отрасль перейдет от периодических процессов к непрерывным, что сделает производство более гибким, локальным и экологичным.
Сегодня процессы непрерывной очистки пептидов и моноклональных антител активно внедряют на таких компаниях как KAI Pharmaceuticals, Lonza, Novartis, ScinoPharm, Bristol-Mayer-Squibb, Pfizer, Merus, Merck Serono, DSM, Novo Nordisk, Roche, JSR и др.
Литература
- Rajendran A., Paredes G., Mazzotti M. Simulated moving bed chromatography for the separation of enantiomers // Journal of Chromatography A. 2009. V. 1216 No. 4. P. 709-738. doi.org/10.1016/j.chroma.2008.10.075
- Luca C.D., Felletti S. and Lievore G. From batch to continuous chromatographic purification of a therapeutic peptide through multicolumn countercurrent solvent gradient purification // Journal of Chromatography A. 2020. V.1625. P. 461304
- Aumann L, Morbidelli M. METHOD AND DEVICE FOR CHROMATOGRAPHIC PURIFICATION// WO/2006/116886
- Müller-Späth T., Ströhlein G., Lyngberg O., Maclean D. Enabling high purities and yields in therapeutic peptide purification using multicolumn countercurrentsolvent gradient purification // Chimica Oggi-Chemistry Today. 2013. V. 31(5) Р. 56-61
- Müller-Späth T., Bavand M. Purification of Synthetic Peptides // Pharmaceutical Engineering. 2019. https://ispe.org/pharmaceutical-engineering/march-april-2019/purification-synthetic-peptides
- Müller-Späth, T., Morbidelli, M. Countercurrent chromatography for the purification of monoclonal antibodies, bispecific antibodies, and antibody-drug conjugates. // Process Scale Purification of Antibodies, 2017. 391–407. doi:10.1002/9781119126942.ch18 ,
- Sander F., Müller-Späth T. Purifying common light-chain bispecific antibodies using MCSGP // Bruckner Analysentechnik GmbH Application Note https://www.bm-at.com/out/media/Application_Purifying_bispecific_antibodies_with_mcsgp.pdf
- Purification of PEGylated proteins with Contichrom // ChromaCon AG Application Note https://www.bm-at.com/out/media/purification_peglyated_proteins.pdf
- N-Rich® – Automated enrichment and purification of minor compounds from complex matrices // ChromaCon Application Note
https://www.chromacon.com/resources/public/lava3/media/kcfinder/files/N-Rich_application_examples
- M. Angarita, T. M¨uller-Sp¨ath, D. Baur, R. Lievrouw,
- Lissens, M. Morbidelli, Twin-column CaptureSMB: a novel cyclic process
for protein A affinity chromatography // Journal of Chromatography A. 2015. V. 1389. P. 85-981
http://dx.doi.org/10.1016/j.chroma.2015.02.046


